基礎醫學(xué)研究所張衛奇/許海燕團隊研發(fā)巖藻多糖載藥納米凝膠聯(lián)合放療增強P-選擇素靶向的腫瘤藥物遞送策略
2023年9月21日,中國醫學(xué)科學(xué)院基礎醫學(xué)研究所張衛奇團隊與許海燕團隊合作在ACS Materials Letters《美國化學(xué)學(xué)會(huì )材料快報》期刊上發(fā)表了題為“Radiotherapy potentiates the P-selectin targeted cancer drug delivery based on a cisplatin and mitoxantrone co-assembled fucoidan nanogel”(放療增效順鉑與米托蒽醌共組裝的巖藻多糖納米凝膠的P-選擇素靶向腫瘤藥物遞送)的研究性論文,并被選為當期封面論文(CoverArticle)(圖1)。該研究報道了一種將巖藻多糖(Fucoidan, Fuc)、化療藥物順鉑(Cisplatin, Cis)和米托蒽醌(Mitoxantrone, Mito)共組裝制備的載藥納米凝膠FCM,進(jìn)一步聯(lián)合放療在小鼠乳腺癌模型中實(shí)現了P-選擇素靶向藥物遞送的增效。
靶向納米藥物針對腫瘤的藥物遞送過(guò)程中,其治療效果在很大程度上取決于納米藥物與腫瘤特異性受體之間的特異性識別。目前,在設計靶向藥物遞送載體時(shí),作為靶標的腫瘤特異性受體的選擇仍十分有限。因此,利用腫瘤新生抗原(Neoantigen,如:腫瘤中新形成或過(guò)表達的細胞受體)以區分腫瘤細胞與正常細胞,進(jìn)而引導納米藥物靶向遞送至腫瘤細胞,在增強抑瘤效果和生物安全性等領(lǐng)域具有重要的應用前景。P-選擇素是一種負責白細胞募集和血小板結合的黏附分子,在部分腫瘤組織中過(guò)表達。研究報道表明,電離輻射(放療)可上調P-選擇素在腫瘤細胞和內皮細胞中的表達,這為指導腫瘤藥物遞送提供了靶點(diǎn)。巖藻多糖(Fuc)是一種天然多糖,對P-選擇素有高親和力,具備良好的生物相容性和獨特的生物活性,已被廣泛應用于食品和藥品行業(yè)。

圖1載藥納米凝膠FCM的抗腫瘤應用(雜志封面圖)。
在該工作中,本研究團隊巧妙地利用巖藻多糖(Fuc)和兩種化療藥物:順鉑(Cis)和米托蒽醌(Mito)之間的分子自組裝,成功構建了FCM納米凝膠(圖2),在對其物理化學(xué)性質(zhì)進(jìn)行表征后,并系統評價(jià)了FCM在體內外的治療效果。研究結果表明,在細胞水平上,放療可以上調4T1小鼠乳腺癌細胞和HUVEC人臍靜脈內皮細胞表面P-選擇素的表達水平,同時(shí)伴隨著(zhù)細胞對FCM的攝入的增加。此外,輻照預處理可增強FCM的細胞毒性。在小鼠乳腺癌模型中,對腫瘤部位進(jìn)行局部輻照預處理可誘導腫瘤P-選擇素的上調,從而進(jìn)一步增效FCM的靶向遞送,提高其抗腫瘤效應。此外,與給藥游離的順鉑與米托蒽醌相比,FCM可以顯著(zhù)降低其系統毒性。本研究中的FCM通過(guò)巖藻多糖介導的P-選擇素靶向聯(lián)合放療的應用,可高效實(shí)現腫瘤的靶向藥物共遞送,為提高藥物的腫瘤靶向遞送效率提供了一種簡(jiǎn)易和低成本的策略。
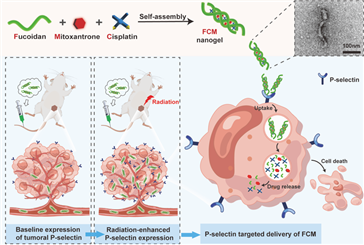
圖2. FCM納米凝膠的制備及作用機制示意圖。
此研究工作得到北京市科技新星計劃(Z201100006820110,Z211100002121016)、細胞生態(tài)海河實(shí)驗室創(chuàng )新基金(22HHXBSS00040)和中國醫學(xué)科學(xué)院醫學(xué)與健康科技創(chuàng )新工程(CIFMS 2021-I2M-1-006)的資助。基礎醫學(xué)研究所張衛奇副研究員和許海燕研究員為論文通訊作者,23年碩士畢業(yè)生王慧敏為論文第一作者。
論文鏈接:https://pubs.acs.org/doi/10.1021/acsmaterialslett.3c00747





